皆さんこんにちは。
受験ドクター講師の勝山利信です。
さて今回は、理科の中和反応をテーマに分析力の鍛え方についてお話しします。
辞書的な意味合いでは複雑な事柄を一つ一つの要素に分け、構成や成分を明らかにすることを分析といいます。理科の問題を解く際、要素は条件と結果して与えられるので、その状況を正しくとらえることが必要になります。
正しくとらえるための準備として必要な知識はしっかりと押さえておきましょう。
中和反応でよく出題されるのが、塩酸と水酸化ナトリウム水溶液を用いた問題です。
反応すると、水と食塩が作られ、完全に中和させれば食塩水ができ上がります。
このとき、少しずつ反応させる量を増やしていき、水を蒸発させたときに残る固体の重さの変化で様子を判断させるような問題が一般的です。具体的な問題を見てみましょう。
ある濃さの塩酸50c㎥に、ある濃さの水酸化ナトリウム水溶液をいろいろな量にして加えました。できた水溶液を加熱して残った固体の重さを調べました。次の表は、加えた水酸化ナトリウム水溶液の量と残った固体の重さの関係についてまとめたものです。このとき、塩酸50c㎥を完全に中和するために必要な水酸化ナトリウム水溶液の量を求めなさい。
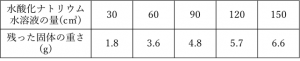
さて、どのように与えられた数値を生かしていけば良いのでしょうか?
理解しやすくするためにまずはグラフにしてみましょう。
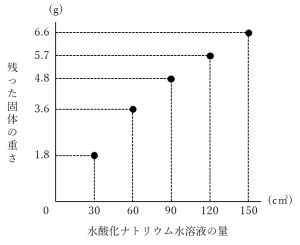
表であたえられた数値をもとに点を打ってみました。
あとは線で結べばグラフになりますが、ここで一点注意です!
折れ線グラフのようにとなり合った点を線で結ぶと完全中和する量が分からなくなってしまいます。
ポイントは完全中和する量の前後でグラフの傾きが異なることです。
次の図のように線を引いてみましょう。

2本の直線が交わった点が完全中和したときの様子を表しています。
テキストで学習するときに完成したグラフを見ることは多いのですが、自分自身でグラフが書けるように練習しておきましょう!
では、実際に量を計算してみます。せっかくグラフにしてあるので、図形としてとらえると計算がスムーズです。水酸化ナトリウム水溶液が30c㎥から60c㎥へ2倍の量になったときに、残った固体の重さも1.8gから3.6gへと2倍になっています。この比例関係がそのまま続けば次のような数値になります。
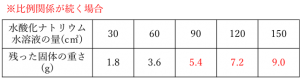
そしてこれをグラフにもかきこむと、三角形の相似が見えてきます!
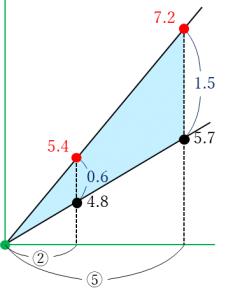
拡大してみましょう。
残った固体の重さについて実際の量と比例関係が続く場合での量の差を考えると、0.6gと1.5gになります。比に表すと2:5となりますが、この比率は横軸の数値を読むときにも当てはめられます。③に当たる量が30c㎥なので、②=20c㎥となり、90−20=70c㎥と、完全中和に必要な水酸化ナトリウム水溶液の量を求めることができました!
理解できると数値だけでも解き進めることができるようになっていきます。
あたえられた数値の情報を分析し正しく使用するためには、どのような変化が起こるのか、まずは知識をしっかりと身につけましょう。そして、計算をスムーズに行うために算数で学習したことも大いに役立てましょう!
目指せ分析力UP!
それでは、またお会いしましょう!




